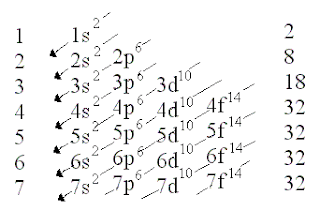POSTULATS ANTERIORS :
DEMÒCRIT: va definir que l'àtom era indivisible.
DALTON: va dir que els àtoms eren unes bolles massisses esfèriques i que es diferenciaven les unes de les altres per el tamany.
THOMSON: va dir que els àtoms eren bolles massisses esfèriques de càrrega pisitiva amb electrons incrustats.
RUTHERFORD: Segons el model atòmic
proposat per Rutherford, l'àtom està constituït per un petit nucli
central format per les partícules de càrrega positiva i una gran
zona externa, l'escorça electrònica, on hi ha els electrons que
giren el seu voltant. Per justificar la neutralitat elèctrica de
l'àtom, el nombre de càrreges positives havia de ser idèntic al
d'electrons.
NOMBRE ATÒMIC I MÀSSIC
A; nombre massic, nombre de nucleons = p+ + n
Z: nombre atòmic, Z = p+ = e- ( quan és un àtom).
A= Z + n n = A - z
ISÒTOPS: són els àtoms que tenen en el nucli el mateix nombre de p+ però un nombre diferent de neutrons.
1.Calcula la massa atòmica mitjana del magnesi a partir de les ades següents:
A mitjana = (24 · 78.7) + ( 25 · 10'13) + (26 · 11'17) = 24'3
100
CONFUGURACIÓ ELECTRÒNICA
És l'ordre de com es col·loquen els
electrons dins els orbitals de l'àtom.
diagrama de MÜLLER
Al = 1s2 2s2
2p6 3s2 3p1 (z = 13)
Ne = 1s2 2s2 2p6
Mg = 1s2 2s2
2p6 3s2
TAULA DE MENDELEJEV
Els elements d'un grup presenten característiques químiques semblants, com més aprop es troben dos elements d'un grup més semblants són, ja que tenen el mateix nombre d'electrons de valència.
El grup és cada una de les columnes de la taula periòdica.

El període és cada una de les files de la taula periòdica.
Caràcter metàl·lic
(Grup) Té més caràcter electrònic perq te mes capes electròniques ( posar nº capes) o té menys caràcter electrònic perq té menys capes electròniques.
(període): té
mes caràcter metàlic perque té mes electrons de valència o té
manco caràcter metàl·lic perq te més electrons de valència
VOLUM DE L'ÀTOM:
(grup) és més petit perque té manco capes electròniques o és mes gran perque té més capes electròniques.
(període): es +
petit pq té + p+ al nucli, fa més força i fa que l'àtom toni
petit o és més gran perque té – p+ al nucli, fa manco F i no fa
tornar l'àtom petit.